| Трифлієва кислота | |
|---|---|
 Трифторметансульфонова кислота
| |
 |
 |
| Назва за IUPAC | Трифторметансульфонова кислота |
| Інші назви | Трифлієва кислота, ТФМС, ТФСК |
| Ідентифікатори | |
| Номер CAS | 1493-13-6 |
| PubChem | 62406 |
| Номер EINECS | 216-087-5 |
| ChEBI | 48511 |
| SMILES | C(F)(F)(F)S(=O)(=O)O |
| InChI | 1/CHF3O3S/c2-1(3,4)8(5,6)7/h(H,5,6,7) |
| Номер Бельштейна | 1812100 |
| Номер Гмеліна | 2805 |
| Властивості | |
| Молекулярна формула | CF3SO3H |
| Молярна маса | 150.07121 г/моль |
| Зовнішній вигляд | Безбарвна рідина |
| Густина | 1.696 г/мЛ |
| Тпл | −40°C |
| Розчинність (вода) | 1600 г/Л |
| Тиск насиченої пари | 3.2 |
| Кислотність (pKa) | −14.7±2.0[1] |
| В'язкість | 1,864–1,881 мм2/с при 20°C |
| Небезпеки | |
| ГГС піктограми |  
|
| Головні небезпеки | Викликає сильні хімічні опіки |
| NFPA 704 | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |

Трифторметансульфонова кислота, скорочена назва: трифлієва кислота, ТФМС, ТФСК або TfOH, є сульфокислотою з хімічною формулою CF3SO3H. Це одна з найсильніших відомих кислот. Трифлієва кислота в основному використовується в дослідженнях як каталізатор етерифікації.[2][3] Це гігроскопічна, безбарвна, злегка в’язка рідина, розчинна в полярних розчинниках.
Синтез
Трифторметансульфонова кислота виробляється шляхом промислового електрохімічного фторування (ЕХФ) метансульфонової кислоти:
Отримана CF3SO2F гідролізується, а отримана трифлатна сіль репротонується. Альтернативою трифторметансульфонова кислота утворюється шляхом окислення трифторметилсульфеніл хлориду:[4]
Трифлієву кислоту очищають методом дистиляції від трифлієвого ангідриду.[3]
Історія
Трифторметансульфонова кислота була вперше синтезована в 1954 році Робертом Хазелдіном і Кіддом за такою реакцією:[5]
Реакції
Як кислота
У лабораторії, трифлієва кислота корисна для протонування, оскільки сполучена основа трифлієвої кислоти є ненуклеофільною. Вона також використовується як кислотний титрант у неводному кислотно-основному титруванні, оскільки вона є сильною кислотою в багатьох розчинниках (ацетонітрил, оцтова кислота тощо), де звичайні мінеральні кислоти (такі як хлоридна або сірчана кислоти) є лише кислотами середньої сили.
Трифлієва кислота кваліфікується як суперкислота, через те що її Ka дорівнює 5×1014, а pKa = −14.7±2.0. Багатьма своїми корисними властивостями вона зобов'язаний своїй високій термічній і хімічній стійкості. І кислота, і її спряжена основа CF3SO−
3, відома як трифлат, протистоїть реакціям окислення/відновлення, тоді як багато сильних кислот, наприклад перхлоратна або нітратна, є окислювачами. Додатково рекомендуючи її використання, трифлієва кислота не сульфонує субстрати, що може бути проблемою для сірчаної кислоти, фторсульфової кислоти та хлорсульфонової кислоти. Нижче наведено прототип сульфування, якому не піддається трифлієва кислота:
Трифлієва кислота випаровується у вологому повітрі та утворює стійкий твердий моногідрат CF3SO3H·H2O, температура плавлення якого 34 °C.
Солеутворення та комплексоутворення
Трифлатний ліганд є лабільним, що відображає його низьку основність. Трифторметансульфонова кислота реагує екзотермічно з карбонатами, гідроксидами та оксидами металів. Прикладом є синтез трифлату міді (II) (Cu(OTf)2).[6]
Хлоридні ліганди можна перетворити на відповідні трифлати:
Це перетворення відбувається у чистому розчині трифлієвої кислоти при 100 °C, з наступним осадженням солі при додаванні ефіру.
Органічна хімія
Трифлієва кислота реагує з ацилгалогенідами з утворенням змішаних трифлатних ангідридів, які є сильними ацилюючими агентами, наприклад, у реакціях Фріделя–Крафтса.
Трифлієва кислота каталізує реакцію ароматичних сполук із сульфоніл хлоридами, ймовірно, також через посередництво змішаного ангідриду сульфонової кислоти.
Трифлієва кислота сприяє іншим реакціям Фріделя-Крафтса, включаючи крекінг алканів і алкілування алкенів, які є дуже важливими для нафтової промисловості. Ці каталізатори, похідні трифлієвої кислоти, дуже ефективні в ізомеризації вуглеводнів з прямим ланцюгом або злегка розгалуженим ланцюгом, що може підвищити октанове число конкретного палива на основі нафти.
Трифлієва кислота реагує екзотермічно зі спиртами з утворенням простих ефірів і олефінів.
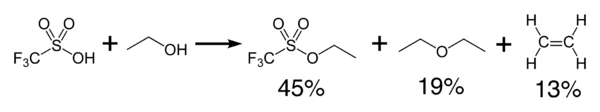
Дегідратація дає ангідрид кислоти, трифторметансульфоновий ангідрид, (CF3SO2)2O.
Безпека
Трифлієва кислота є однією з найсильніших кислот. Контакт зі шкірою викликає сильні опіки з уповільненим руйнуванням тканин. При вдиханні вона викликає смертельні спазми, запалення та набряк.[7]
Подібно до сірчаної кислоти, трифлієву кислоту необхідно повільно додавати до полярних розчинників, щоб запобігти термічному витоку.
Список літератури
- ↑ Trummal, A.; Lipping, L.; Kaljurand, I.; Koppel, I. A.; Leito, I. (2016). Acidity of Strong Acids in Water and Dimethyl Sulfoxide. Journal of Physical Chemistry A. 120 (20): 3663—3669. Bibcode:2016JPCA..120.3663T. doi:10.1021/acs.jpca.6b02253. PMID 27115918. S2CID 29697201.
- ↑ Howells, R. D.; McCown, J. D. (1977). Trifluoromethanesulfonic Acid and Derivatives. Chemical Reviews. 77 (1): 69—92. doi:10.1021/cr60305a005.
- ↑ а б Encyclopedia of reagents for organic synthesis. ISBN 0-471-93623-5.
- ↑ Siegemund, G.; Schwertfeger, W.; Feiring, A.; Smart, B.; Behr, F.; Vogel, H.; McKusick, B. (2000). Fluorine Compounds, Organic. Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons. doi:10.1002/14356007.a11_349. ISBN 3527306730.
- ↑ Haszeldine, R. N.; Kidd, J. M. (1954). Perfluoroalkyl derivatives of sulphur. Part I. Trifluoromethanesulphonic acid. Journal of the Chemical Society. 1954: 4228—4232. doi:10.1039/JR9540004228.
- ↑ Dixon, N. E.; Lawrance, G. A.; Lay, P. A.; Sargeson, A. M.; Taube, H. (1990). Trifluoromethanesulfonates and trifluoromethanesulfonato-O complexes. У Angelici, R. J. (ред.). Reagents for Transition Metal Complex and Organometallic Syntheses. Inorganic Syntheses. Т. 28. с. 70—76. doi:10.1002/9780470132593.ch16. ISBN 978-0-470-13259-3.
- ↑ Trifluoromethanesulfonic acid MSDS. ChemCAS. Архів оригіналу за 2 квітня 2015. Процитовано 20 жовтня 2023.













![{\displaystyle {\ce {C6H6 + H2SO4 ->[{\ce {SO3}}] C6H5(SO3H) + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0171ff1338e1974d73935d46ca6110c9ad3f5c27)

![{\displaystyle {\ce {3 CF3SO3H + [Co(NH3)5Cl]Cl2 -> [Co(NH3)5O3SCF3](O3SCF3)2 + 3 HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16bc6679aa18a720c03cd65ce7033a8da12409f1)





