Селективні модулятори рецепторів естрогену (SERM), також відомі як агоністи/антагоністи рецепторів естрогену (ERAA),[1][2] — це клас препаратів, що діють на рецептори естрогену (ER).[3] Порівняно з чистими агоністами — антагоністами ER (наприклад, повними агоністами та мовчазними антагоністами), SERM є більш тканинноспецифічними, що дозволяє їм вибірково пригнічувати або стимулювати естрогеноподібну дію в різних тканинах.
Медичне використання
SERM використовуються для лікування різних захворювань, пов'язаних з естрогеном, включаючи лікування овуляторної дисфункції при лікуванні безпліддя, профілактику постменопаузального остеопорозу, лікування та зниження ризику раку молочної залози[4] та лікування диспареунії, спричиненої менопаузою. SERM також використовуються в комбінації з кон'югованими естрогенами, показаними для лікування симптомів дефіциту естрогену та вазомоторних симптомів, пов'язаних з менопаузою.[5]
SERM також досліджуються для використання в гормональній терапії транссексуальності у деяких небінарних трансгендерних осіб, які при народженні мали чоловічу стать. На відміну від повних агоністів рецепторів естрогену, таких як естрадіол, які викликають широкий розвиток жіночих вторинних статевих ознак, SERM можна використовувати для досягнення часткової фемінізації у осіб, які бажають розвинути певні жіночі риси, такі як м'якша шкіра та жіночий розподіл жиру в організмі без значного зростання грудей.[6] На відміну від біоідентичних естрогенів, SERM самі по собі не пригнічують вироблення тестостерону і тому використовуються разом з антиандрогенами, такими як ципротерону ацетат або спіронолактон. Використання SERM для гормональної терапії транссексуальності, все ще є відносно новим та рідкісним явищем, оскільки дослідження їхньої ефективності та безпеки при тривалому застосуванні обмежені.[7]
Приклади
Тамоксифен — це гормональний препарат першої лінії для лікування ER-позитивного метастатичного раку молочної залози. Його використовують для зниження ризику раку молочної залози у жінок з високим ризиком, а також як допоміжне лікування протокової карциноми in situ з негативним та позитивним ураженням пахвових лімфатичних вузлів.[8][9] Тамоксифен також використовується для лікування остеопорозу та підвищення рівня ліпідів крові у жінок у постменопаузі. Побічні ефекти тамоксифену включають припливи та підвищення ризику розвитку раку ендометрію порівняно з жінками аналогічного віку.[9][10]
Тореміфен, хлороване похідне тамоксифену, розроблений для запобігання раку печінки, у доклінічних дослідженнях був пов'язаний з меншою кількістю аддуктів ДНК у печінці, ніж тамоксифен. Він використовується як ендокринна терапія для жінок з естроген- або прогестерон-позитивним раком молочної залози 4 стадії або рецидивуючим метастатичним раком молочної залози[11] та продемонстрував подібну ефективність порівняно з тамоксифеном як ад'ювантне лікування раку молочної залози та при лікуванні метастатичного раку молочної залози[12].
Ралоксифен використовується для профілактики та лікування постменопаузального остеопорозу та профілактики раку молочної залози у жінок у постменопаузі з високим ризиком остеопорозу.[13] Доклінічні та клінічні звіти свідчать про те, що він значно менш ефективний, ніж естроген, для лікування остеопорозу. Він був пов'язаний з прийнятним профілем ендометрію та не мав тамоксифен-подібного впливу на матку, але був пов'язаний з такими побічними ефектами, як венозна тромбоемболія та вазомоторні симптоми, включаючи припливи.[14]
Оспеміфен є аналогічним метаболітом тореміфену. На відміну від тамоксифену, тореміфен не є гепатоканцерогеном для щурів, тому оспеміфен також є безпечнішим SERM, ніж тамоксифен.[15] Його використовують для лікування диспареунії середнього та тяжкого ступеня, симптому атрофії вульви та піхви, пов'язаної з менопаузою. Клінічні дані щодо раку молочної залози відсутні, але дані як in vitro, так і in vivo свідчать про те, що оспеміфен може мати хіміопрофілактичну активність у тканинах молочної залози.[16]
Базедоксифен використовується для лікування остеопорозу у жінок у постменопаузі з підвищеним ризиком переломів. Було показано, що він відносно безпечний і добре переноситься. Він не показує стимуляції молочної залози або ендометрію, і протягом перших двох років мав кращі результати при венозній тромбоемболії у довгостроковій перспективі щодо інших SERM. Перевага базедоксифену над ралоксифеном полягає в тому, що він підвищує активність ендотеліальної синтази оксиду азоту та не протидіє впливу 17β-естрадіолу на вазомоторні симптоми.[17]
Перший тканинно-селективний естрогенний комплекс (TSEC) поєднує кон'юговані естрогени та SERM базедоксифен для поєднання їхньої активності. Комбінована терапія застосовується для лікування помірних та тяжких вазомоторних симптомів, пов'язаних з менопаузою, профілактики постменопаузального остеопорозу, а також лікування симптомів дефіциту естрогенів у жінок у постменопаузі, які не перенесли гістеректомію. Така комбінація дозволяє скористатися перевагами естрогену щодо полегшення вазомоторних симптомів без естрогенної стимуляції ендометрію.[18][19]
SERM також використовували у деяких трансгендерних пацієнтів в гормонозамісній терапії[20]
ДГЕД — це центрально селективний, перорально активний пролік естрадіолу.
Доступні форми
SERM доступні для використання у клінічній і ветеринарній практиці:
| Назва | Торгова назва | Показання | Початок реєстрації | Примітки |
|---|---|---|---|---|
| Анордрин | Zi Yun | Негайна контрацепція | 1970-ті | Тільки в КНР в комбінації міфепристоном |
| Базедоксифен | Duavee | Профілактика остеопорозу | 2013 | В комбінації з кон'югованими естрогенами |
| Бропарестрол | Acnestrol | Дерматологія. Лікування раку молочної залози | 1970-ті | Використання припинено |
| Кломіфен | Clomid | Жіноче безпліддя | 1967 | |
| Цикрофеніл | Sexovid | Жіноче безпліддя; Менопауза | 1970 | Використання припинено |
| Лазофоксифен | Fablyn | Профілактика, лікування остеопорозу; Атрофія піхви | 2009 | Тільки у Литві та Португалії |
| Ормелоксифен | Saheli | Гормональна контрацепція | 1991 | Тільки в Індії |
| Оспеміфен | Osphena | Диспареунія через вагінальну атрофію | 2013 | |
| Ралоксифен | Evista | Профілактика і лікування остеопорозу; профілактика раку молочної залози | 1997 | |
| Тамоксифен | Nolvadex | Лікування раку молочної залози | 1978 | |
| Тореміфен | Fareston | Лікування раку молочної залози | 1997 |
Фармакологія
Фармакодинаміка
SERM є конкурентними частковими агоністами ER.[21] Різні тканини мають різний ступінь чутливості до активності ендогенних естрогенів, тому SERM виробляють естрогенні або антиестрогенні ефекти залежно від досліджуваної тканини, а також від відсотка внутрішньої активності (IA) SERM.[22] Прикладом SERM з високою IA і, отже, переважно естрогенною дією є хлоротріанізен, тоді як прикладом SERM з низькою IA і, отже, переважно антиестрогенною дією є етамокситрифетол. SERM, такі як кломіфен і тамоксифен, мають порівняно більш середні показники за своєю інсулінорезистентністю та балансом естрогенної та антиестрогенної активності. Ралоксифен — це SERM, який має більшу антиестрогенну дію, ніж тамоксифен; обидва є естрогенними в кістках, але ралоксифен є антиестрогенним у матці, тоді як тамоксифен є естрогенним у цій частині тіла.[22]
Місце зв'язування

SERM діють на рецептор естрогену (ER), який є внутрішньоклітинним, ліганд-залежним активатором транскрипції та належить до родини ядерних рецепторів.[23] Було ідентифіковано два різних підтипи ER: ERα та ERβ. ERα вважається основним середовищем, де сигнали естрогену трансдукуються на транскрипційному рівні, і є переважним ER у жіночому репродуктивному тракті та молочних залозах, тоді як ERβ знаходиться переважно в ендотеліальних клітинах судин, кістках та тканині чоловічої простати.[24] Відомо, що концентрація ERα та ERβ у тканинах відрізняється під час розвитку, старіння або захворювання.[25] Багато характеристик схожі між цими двома типами, такі як розмір (~600 та 530 амінокислот) та структура. ERα та ERβ мають приблизно 97 % ідентичності амінокислотної послідовності в ДНК-зв'язуючому домені та близько 56 % в ліганд-зв'язуючому домені.[23][25] Основна відмінність ліганд-зв'язуючих доменів визначається Leu -384 та Met -421 в ERα, які замінюються Met-336 та Ile -373 відповідно в ERβ.[26] Варіація більша на N-кінці між ERα та ERβ.[27]
ДНК-зв'язуючий домен складається з двох субдоменів. Один з проксимальним блоком, який бере участь у розпізнаванні ДНК, тоді як інший містить дистальний блок, відповідальний за димеризацію ДНК-залежного ДНК-зв'язуючого домену. Послідовність проксимального блоку ідентична між ERα та ERβ, що вказує на подібну специфічність та спорідненість між двома підгрупами. Глобулярні білки ДНК-зв'язуючого домену містять вісім цистеїнів і дозволяють тетраедричну координацію двох іонів цинку. Ця координація робить можливим зв'язування ЕР з елементами відповіді на естроген.[28] Ліганд-зв'язуючий домен являє собою глобулярну тришарову структуру, що складається з 11 спіралей і містить кишеню для природного або синтетичного ліганду.[28][29] Факторами, що впливають на спорідненість зв'язування, є головним чином наявність фенольного фрагмента, розмір і форма молекули, подвійні зв'язки та гідрофобність.[30]
Диференціальне позиціонування спіралі 12 активуючої функції 2 (AF-2) у ліганд-зв'язуючому домені зв'язаним лігандом визначає, чи має ліганд агоністичний та антагоністичний ефект. У рецепторах, пов'язаних з агоністом, спіраль 12 розташована поруч зі спіралями 3 та 5. Спіралі 3, 5 та 12 разом утворюють поверхню зв'язування для мотиву NR-боксу, що міститься в коактиваторах з канонічною послідовністю LXXLL (де L являє собою лейцин або ізолейцин, а X — будь-яку амінокислоту). Нелігандовані (апо) рецептори або рецептори, зв'язані з антагоністичними лігандами, відвертають спіраль 12 від поверхні, що зв'язує LXXLL, що призводить до переважного зв'язування довгого мотиву, багатого на лейцин, LXXXIXXX(I/L), присутнього на корепресорах NCoR1 або SMRT. Крім того, деякі кофактори зв'язуються з ЕР через терміналі, сайт зв'язування з ДНК або інші сайти зв'язування. Таким чином, одна сполука може бути агоністом ЕР у тканині, багатій на коактиватори, але антагоністом ЕР у тканинах, багатих на корепресори.[31]
Механізм дії

Естрогенні сполуки охоплюють широкий спектр дії, включаючи:
- Повні агоністи (агоністи у всіх тканинах), такі як природний ендогенний гормон естрадіол.
- Змішані агоністи/антагоністи (агоністичні в одних тканинах і антагоністичні в інших), такі як тамоксифен (SERM).
- Чисті антагоністи (антагоністичні у всіх тканинах), такі як фулвестрант.
Відомо, що SERM стимулюють естрогенну дію в таких тканинах, як печінка, кістки та серцево-судинна система, але також відомо, що вони блокують дію естрогену там, де стимуляція небажана, наприклад, у грудях та матці.[34] Ця агоністична або антагоністична активність викликає різноманітні структурні зміни рецепторів, що призводить до активації або репресії генів-мішеней естрогенів.[35][34][36][37] SERM взаємодіють з рецепторами шляхом дифузії в клітини та зв'язування з субодиницями ERα або ERβ, що призводить до димеризації та структурних змін рецепторів. Це полегшує взаємодію SERM з елементами естроген-відповіді, що призводить до активації естроген-індукованих генів та опосередковує ефекти естрогену.[34]
Унікальною особливістю SERM є їхня тканинно- та клітинно-селективна активність. З'являється все більше доказів того, що активність SERM головним чином визначається селективним залученням корепресорів та коактиваторів до генів-мішеней ER у певних типах тканин та клітин.[38][39][40] SERM можуть впливати на стабільність білка-коактиватора, а також регулювати його активність шляхом посттрансляційних модифікацій, таких як фосфорилювання. Численні сигнальні шляхи росту, такі як HER2, PKC, PI3K та інші, знижуються у відповідь на лікування антиестрогенами. Коактиватор стероїдного рецептора 3 (SRC-3) фосфорилюється активованими кіназами, які також посилюють його коактиваторну активність, впливають на ріст клітин і зрештою сприяють розвитку лікарської стійкості.[40]
Співвідношення ERα та ERβ у цільовій ділянці може бути ще одним способом визначення активності SERM. Високий рівень клітинної проліферації добре корелює з високим співвідношенням ERα:ERβ, але пригнічення клітинної проліферації корелює з домінуванням ERβ над ERα. Співвідношення ендоплазматічних рецепторів (ER) у неопластичній та нормальній тканині молочної залози може бути важливим при розгляді хіміопрофілактики за допомогою SERM.[41][42][43][44]
Розглядаючи відмінності між ERα та ERβ, важливими є Активуюча функція 1 (AF-1) та AF-2. Разом вони відіграють важливу роль у взаємодії з іншими корегуляторними білками, що контролюють транскрипцію генів.[45][46] AF-1 розташований на N-кінці ER та є лише на 20 % гомологічним з ERα та ERβ. З іншого боку, AF-2 дуже схожий за складом ERα та ERβ, і відрізняється лише однією амінокислотою.[46] Дослідження показали, що шляхом перемикання ділянок AF-1 в ERα та ERβ виникають специфічні відмінності в транскрипційній активності. Зазвичай, SERM можуть частково активувати гени, отримані за допомогою ERα, за допомогою рецептора естрогену, але не через ERβ.[45][46][47] Хоча ралоксифен та активна форма тамоксифену можуть стимулювати AF-1-регульовані репортерні гени як в ERα, так і в ERβ.[46]
Завдяки відкриттю двох підтипів ER, це призвело до синтезу низки рецептор-специфічних лігандів, які можуть вмикати або вимикати певний рецептор.[48] Однак, зовнішня форма отриманого комплексу стає каталізатором зміни реакції тканинної мішені на SERM.[49][50][48][51]
Рентгенівська кристалографія естрогенів або антиестрогенів показала, як ліганди програмують рецепторний комплекс для взаємодії з іншими білками. Ліганд-зв'язуючий домен ER демонструє, як ліганди сприяють та запобігають зв'язуванню коактиватора залежно від форми естрогенного або антиестрогенного комплексу. Широкий спектр лігандів, що зв'язуються з ER, може створювати спектр ER-комплексів, які є повністю естрогенними або антиестрогенними у певній цільовій ділянці.[52][53][54] Основним результатом зв'язування ліганду з ER є структурна перебудова кишені зв'язування ліганду, головним чином в AF-2 С-кінцевої області. Зв'язування лігандів з ER призводить до утворення гідрофобної кишені, яка регулює кофактори та фармакологію рецепторів. Правильне згортання ліганд-зв'язуючого домену необхідне для активації транскрипції та для взаємодії ER з низкою коактиваторів.[53]
Коактиватори — це не просто білкові партнери, які з'єднують ділянки разом у комплекс. Коактиватори відіграють активну роль у модифікації активності комплексу. Посттрансляційна модифікація коактиваторів може призвести до динамічної моделі дії стероїдних гормонів за допомогою кількох кіназних шляхів, ініційованих рецепторами факторів росту клітинної поверхні. Під керівництвом безлічі ремоделяторів білків для формування мультибілкового коактиваторного комплексу, який може взаємодіяти з фосфорильованим ER у певному сайті промотора гена, основний коактиватор спочатку повинен залучити певний набір кокоактиваторів. Білки, які основний коактиватор збирає у вигляді комплексу, що коактивується ядром, мають індивідуальну ферментативну активність для метилювання або ацетилювання сусідніх білків. Субстрати ER або коензим А можуть бути поліубіквітиновані шляхом кількох циклів реакції, або, залежно від зв'язувальних білків, вони можуть бути або додатково активовані, або деградовані 26S протеасомою.[55]
Отже, для ефективної транскрипції генів, яка програмується та цільова, залежить від структури та статусу фосфорилювання ER та коактиваторів, необхідний динамічний та циклічний процес ремоделювання здатності до транскрипційного складання, після чого транскрипційний комплекс миттєво руйнується протеасомою.[56]
Структура та функція
Зв'язки між структурою та активністю
Основна структура SERM імітує шаблон 17β-естрадіолу. Вони мають два ароматичні кільця, розділені 1-3 атомами (часто стильбеновий тип розташування). Між двома фенілами ядра, SERM зазвичай мають 4-заміщену фенільну групу, яка, зв'язуючись з ER, виступає з позиції естратрієнового ядра, так що спіраль 12 рухається від отвору рецептора та блокує простір, де зазвичай зв'язуються білки-коактиватори та викликають агоністичну активність ER. У основній частині SERM було багато варіацій, тоді як гнучкість щодо того, що допускається в бічному ланцюзі, була меншою.[57] SERM можна класифікувати за їхньою основною структурою.
Трифенілетилени першого покоління

Першим основним структурним класом молекул типу SERM, про який повідомлялося, є трифенілетілени. Стильбенове ядро (подібне до нестероїдного естрогену, діетилстильбестролу) по суті імітує стероїдні естрогени, такі як 17β-естрадіол, тоді як бічний ланцюг перекривається з 11-ю позицією стероїдного ядра.[58] Похідні трифенілетилену мають додаткову фенільну групу, приєднану до етиленового містка. Здатність фенолів утворювати водневі зв'язки у 3-позиції є важливою вимогою для зв'язування з ендоплазматичним ретикулуматом.[59]

Перший препарат, кломіфен[60] має хлор- замісник на етиленовому бічному ланцюзі, що забезпечує подібну спорідненість зв'язування, як і пізніше відкритий препарат тамоксифен. Кломіфен — це суміш естрогенних (цис-форма) та антиестрогенних ізомерів (транс-форма).[61] Цис- та транс-форми визначаються з точки зору геометричних співвідношень двох незаміщених фенільних кілець.[60] Два ізомери кломіфену мають різні профілі, де транс-форма має активність, більш схожу на тамоксифен, тоді як цис-форма поводиться більше як 17β-естрадіол.[62] Цис-активність приблизно в десять разів сильніша за транс-активність. Однак, транс-ізомер є найпотужнішим стимулятором гіпертрофії епітеліальних клітин, оскільки кломіфен є антагоністом у низьких дозах та агоністом у високих.[60] Ізомери антагоніста можуть викликати гальмівні естрогенні ефекти в раку матки та молочної залози, але естрогенний ізомер може поєднуватися з новими рецепторами, спричиняючи естрогеноподібні ефекти в кістках.[63]

Тамоксифен став препаратом вибору для жінок, у яких діагностовано всі стадії гормонозалежного раку молочної залози, тобто рак молочної залози, який є одночасно ER та/або прогестерон-позитивним. У США його також призначають для профілактичної хіміопрофілактики жінкам з високим ризиком раку молочної залози.[64] Тамоксифен є чистим антиестрогенним транс-ізомером і має різну дію на тканини-мішені естрогенів по всьому організму. Тамоксифен має селективну антиестрогенну дію в молочній залозі, але естрогеноподібну дію в кістках та раку ендометрію.[65] Тамоксифен піддається метаболізму I фази в печінці за допомогою мікросомальних ферментів цитохрому P450 (CYP). Основними метаболітами тамоксифену є N -десметилтамоксифен та 4-гідрокситамоксифен.
Кристалографічна структура 4-гідрокситамоксифену[66] взаємодіє з амінокислотами ER в межах ліганд-зв'язуючого домену.[67] Контакт між фенольною групою, молекулою води та глутаматом і аргініном у рецепторі (ERα; Glu 353/Arg 394) завершується зв'язуванням з високою спорідненістю, так що 4-гідрокситамоксифен з фенольним кільцем, що нагадує кільце А 17β-естрадіолу, має більш ніж у 100 разів вищу відносну спорідненість зв'язування, ніж тамоксифен, який не містить фенолу. Якщо його ОН-група видаляється або його положення змінюється, спорідненість зв'язування знижується.[68][69]
Трифенілетиленова частина та бічний ланцюг необхідні для зв'язування тамоксифену з ER, тоді як для 4-гідрокситамоксифену бічний ланцюг та фенілпропен не є вирішальними структурними елементами для зв'язування з ER. Основність та довжина бічного ланцюга, здається, не відіграють вирішальної ролі для спорідненості зв'язування тамоксифену з ER або β-кільцем тамоксифену, але стильбеновий фрагмент тамоксифену необхідний для зв'язування з ER. Гідроксильна група має особливе значення для зв'язування 4-гідрокситамоксифену з ER, а етильний бічний ланцюг тамоксифену виступає з ліганд-зв'язуючого домену ER.[70]
У небагатьох користувачів тамоксифену спостерігалося підвищення рівня раку матки, припливів та тромбоемболій. Препарат також може спричинити гепатокарциноми у щурів. Ймовірно, це пов'язано з етильною групою ядра тамоксифен-стильбену, яка піддається алільній окислювальній активації, що викликає алкілування ДНК та розрив ланцюга. Цю проблему пізніше виправили в тореміфені.[71] Тамоксифен має більш нерозбірливий вплив, ніж ралоксифен, на цільові ділянки через зв'язок між амінокислотою ER в Asp-351 та антиестрогенним бічним ланцюгом SERM. Бічний ланцюг тамоксифену не може нейтралізувати Asp-351, тому цей сайт алостерично впливає на AF-1 на проксимальному кінці ER. Цю проблему вирішує препарат другого покоління ралоксифен.[72]

Тореміфен — це хлорована похідна нестероїдного трифеніетиленового антиестрогену тамоксифену[73] з хлорним замісником на етиленовому бічному ланцюзі, що забезпечує спорідненість зв'язування, подібну до тамоксифену[74]. Структура та активність тореміфену подібні до тамоксифену, але він суттєво покращений порівняно зі старим препаратом щодо алкілування ДНК. Присутність доданого атома хлору знижує стабільність катіонів, утворених з активованих алільних метаболітів, і таким чином зменшує потенціал алкілування, і справді тореміфен не демонструє утворення аддуктів ДНК у гепатоцитах гризунів. Тореміфен захищає від втрати кісткової маси у щурів з видаленими оваріоектомією та клінічно впливає на маркери резорбції кісток подібно до тамоксифену.[73] Тореміфен піддається метаболізму I фази за допомогою мікросомальних ферментів цитохрому P450, подібно до тамоксифену, але переважно ізоформою CYP3A4. Тореміфен утворює два свої основні метаболіти, N-десметилтореміфен та деаміногідрокси-тореміфен (оспеміфен), шляхом N-деметилювання та дезамінування-гідроксилювання. N-десметилтореміфен має подібну ефективність, як і тореміфен, тоді як 4-гідрокситореміфен має вищу спорідненість зв'язування з ЕР, ніж тореміфен.[75] 4-гідрокситореміфен має роль, подібну до 4-гідрокситамоксифену.[76]
Бензотіофени другого покоління

Ралоксифен належить до бензотіофенових SERM препаратів другого покоління. Він має високу спорідненість до ER з потужною антиестрогенною активністю та тканинно-специфічними ефектами, відмінними від естрадіолу.[77] Ралоксифен є агоністом ER у кістковій тканині та серцево-судинній системі, але в тканинах молочної залози та ендометрії він діє як антагоніст ER. Він екстенсивно метаболізується шляхом кон'югації з глюкуронідами в кишечнику, і тому має низьку біодоступність, що становить лише 2 %, тоді як біодоступність тамоксифену та тореміфену становить приблизно 100 %.[78]
Перевагою ралоксифену над трифенілетилен-тамоксифеном є зменшення впливу на матку. Гнучка шарнірна група, а також антиестрогенний феніл-4-піперидіноетоксі бічний ланцюг важливі для мінімізації впливу на матку. Завдяки своїй гнучкості бічний ланцюг може займати ортогональне положення відносно ядра[79] так що амінна група бічного ланцюга ралоксифену знаходиться на 1 Å ближче, ніж тамоксифени, до амінокислоти Asp-351 у ліганд-зв'язуючому домені ERα.[80][81]
Критичну роль тісного зв'язку між гідрофобним бічним ланцюгом ралоксифену та гідрофобним залишком рецептора у зміні як форми, так і заряду зовнішньої поверхні комплексу SERM-ER було підтверджено за допомогою похідних ралоксифену. Коли інтерактивна відстань між ралоксифеном та Asp-351 збільшується з 2,7 Å до 3,5-5 Å, це викликає посилення естрогеноподібної дії комплексу ралоксифен-ERα. Коли піперидинове кільце ралоксифену замінюється циклогексаном, ліганд втрачає антиестрогенні властивості та стає повноцінним агоністом. Взаємодія між антиестрогенним бічним ланцюгом SERM та амінокислотою Asp-351 є важливим першим кроком у придушенні AF-2. Він переміщує спіраль 12 подалі від ліганд-зв'язуючої кишені, тим самим запобігаючи зв'язуванню коактиваторів з комплексом SERM-ER.[82][83]
Третє покоління

Препарати третього покоління або не стимулюють матку, не покращують потенцію, не демонструють значного збільшення припливів, або демонструють комбінацію цих ознак.[84]
Перший дигідронафталіновий SERM, нафоксидин, був клінічним кандидатом для лікування раку молочної залози, але мав побічні ефекти, включаючи сильну фототоксичність. Нафоксидин має всі три фенільні групи, обмежені в копланарному розташуванні, як і тамоксифен. Але при гідруванні подвійний зв'язок нафоксидену відновлюється, і обидва феніли мають цис-орієнтацію. Амінвмісний бічний ланцюг може потім прийняти аксіальну конформацію та розташувати цю групу ортогонально до площини ядра, як у ралофоксифена та інших менш утеротропних SERM.
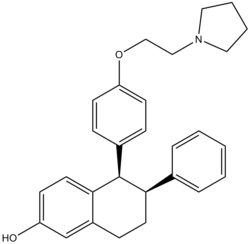
Модифікації нафоксидину призвели до утворення лазофоксифену. Лазофоксифен є одним з найпотужніших SERM, про які повідомлялося щодо захисту від втрати кісткової маси та зниження рівня холестерину. Чудова пероральна активність лазофоксифену пояснюється зниженою кишковою глюкуронізацією фенолу.[85] На відміну від ралоксифену, лазофоксифен задовольняє вимоги фармакофорної моделі, яка передбачає стійкість до глюкуронізації стінки кишечника. Структурною вимогою є неплоска топологія зі стеричною масою близькою до площини конденсованої біциклічної ароматичної системи.[86] Взаємодія між ER та лазофоксифеном узгоджується із загальними особливостями розпізнавання SERM-ER. Великий гнучкий бічний ланцюг лазофоксифену закінчується піролідиновою головною групою та простягається до поверхні білка, де безпосередньо перешкоджає позиціонуванню спіралі AF-2. Між лазофоксифеном та Asp-351 утворюється сольовий місток. Нейтралізація заряду в цій ділянці ER може пояснити деякі антиестрогенні ефекти, що здійснюються лазофоксифеном.[87]

Індольна система служила основною одиницею в SERM, і коли амін приєднується до індолу за допомогою бензилоксиетилу, отримані сполуки, як було показано, не мають доклінічної активності щодо матки, водночас не уражаючи кістки щурів з повною ефективністю при низьких дозах. Базедоксифен є однією з таких сполук. Основний зв'язувальний домен складається з 2-феніл-3-метиліндолу та гексаметиленамінового кільця в аффектерній ділянці бічного ланцюга. Метаболізується шляхом глюкуронізації, з абсолютною біодоступністю 6,2 %, що в 3 рази вище, ніж у ралоксифену. Він має агоністичну дію на кістковий та ліпідний метаболізм, але не на ендометрій молочної залози та матки.[88] Він добре переноситься і не призводить до збільшення частоти припливів, гіпертрофії матки або болючості молочних залоз.[89]

Оспеміфен є трифенілетіленом та відомим метаболітом тореміфену. За структурою він дуже схожий на тамоксифен і тореміфен. Оспеміфен не має 2-(диметиламіно)етоксигрупи, як тамоксифен. Дослідження взаємозв'язку структури та активності показали, що шляхом видалення цієї групи тамоксифену агоністична активність у матці значно знижується, але не в кістках та серцево-судинній системі. Доклінічні та клінічні дані показують, що оспеміфен добре переноситься без суттєвих побічних ефектів. Переваги, які оспеміфен може мати порівняно з іншими SERM, полягають у його нейтральній дії на припливи та дії агоніста ER на піхву, покращуючи симптоми сухості піхви.[90]
Режими зв'язування

Відомо, що SERM мають чотири різні способи зв'язування з ER. Однією з цих особливостей є міцні водневі зв'язки між лігандом та Arg-394 та Glu-353 ERα, які вистилають «кишеню А-кільця» та допомагають ліганду залишатися в кишені зв'язування ER. Це відрізняється від 17β-естрадіолу, який зв'язаний водневими зв'язками з His-524 у «кишені D-кільця».[91] Інші відмінні зв'язки з ліганд-зв'язуючою кишенею мають майже планарну «основну» структуру, яка зазвичай складається з біарильного гетероциклу, еквівалентного А-кільцю та В-кільцю 17β-естрадіолу, до відповідного сайту зв'язування; об'ємний бічний ланцюг від біарильної структури, аналогічний В-кільцю 17β-естрадіолу, та, нарешті, друга бічна група, яка є еквівалентом С- та D-кільця та зазвичай ароматична, заповнює решту об'єму ліганд-зв'язуючої кишені.[92]
Невеликі відмінності між двома підтипами ER були використані для розробки селективних до цих підтипів модуляторів ER, але висока схожість між цими двома рецепторами робить розробку дуже складною. Амінокислоти в ліганд-зв'язуючих доменах відрізняються у двох позиціях: Leu-384 та Met-421 в ERα та Met-336 та Ile-373 в ERβ, але вони мають подібну гідрофобність та займані об'єми. Однак, форми та обертальний бар'єр амінокислотних залишків не однакові, що призводить до розрізнення α- та β-грані зв'язуючої порожнини між ERα та ERβ. Це призводить до ERα-переважного зв'язування замісників ліганду, які вирівняні вниз до Met-336, тоді як замісники ліганду, вирівняні вгору до Met-336, з більшою ймовірністю зв'язуються з ERβ. Ще одна відмінність полягає в заміні Val-392 в ERα на Met-344 в ERβ. Об'єм зв'язуючої кишені ERβ дещо менший, а форма дещо відрізняється від ERα. Багато ERβ-селективних лігандів мають переважно планарне розташування, оскільки порожнина зв'язування ERβ трохи вужча, ніж у ERα, однак це саме по собі призводить до помірної селективності. Для досягнення сильної селективності ліганд повинен розміщувати замісники дуже близько до однієї або кількох амінокислотних відмінностей між ERα та ERβ, щоб створити сильну силу відштовхування до рецептора іншого підтипу. Крім того, структура ліганду повинна бути жорсткою. В іншому випадку, відштовхувальні взаємодії можуть призвести до конформаційної зміни ліганду та, отже, створити альтернативні режими зв'язування.[93]
Трифенілетилени першого покоління
Тамоксифен перетворюється цитохромом P450 печінки на 4-гідрокситамоксифен[94] та є більш селективним антагоністом підтипу ERα, ніж ERβ.[95] 4-гідрокситамоксифен зв'язується з ER у тій самій кишені зв'язування, яка розпізнає 17β-естрадіол. Розпізнавання рецепторами 4-гідрокситамоксифену, ймовірно, контролюється двома структурними особливостями 4-гідрокситамоксифену: фенольним кільцем А та об'ємним бічним ланцюгом. Фенольне кільце А утворює водневі зв'язки з бічними групами Arg-394, Glu-354 ендоплазматического ретикулуму та зі структурно консервативною водою. Об'ємний бічний ланцюг, що виступає з порожнини зв'язування, зміщує спіраль 12 з кишені зв'язування ліганду, щоб покрити частину кишені зв'язування коактиватора. Утворення комплексу ER-4-гідрокситамоксифен залучає білки-корепресори. Це призводить до зниження синтезу ДНК та пригнічення активності естрогенів.[94] Кломіфен і торімефен мають спорідненість зв'язування, подібну до тамоксифену.[96] Таким чином, ці два препарати є більш селективними антагоністами підтипу ERα, ніж ERβ.[95]
Бензотіофени другого покоління

Ралоксифен, як і 4-гідрокситамоксифен, зв'язується з ERα за допомогою гідроксильної групи свого фенольного «кільця А» через водневі зв'язки з Arg-394 та Glu-353. Окрім цих зв'язків, ралоксифен утворює другий водневий зв'язок з ER через бічну групу His-524 завдяки наявності другої гідроксильної групи в «D-кільці». Цей водневий зв'язок також відрізняється від зв'язку між 17β-естрадіолом та His-524, оскільки імідазольне кільце His-524 повернуте, щоб протидіяти різниці в положенні кисню в ралоксифені та 17β-естрадіолі. Як і у 4-гідрокситамоксифені, об'ємний бічний ланцюг ралоксифену витісняє спіраль 12.[97]
Третє покоління
Взаємодія лазофоксифену з ERα типова для взаємодії SERM-ERα, така як майже планарна топологія (тетрагідронафталіновий карбоцикл), водневі зв'язки з Arg-394 та Glu-353, а також фенільні бічні ланцюги лазофоксифену, що заповнюють об'єм C-кільця та D-кільця кишені зв'язування ліганду. Лазофоксифен відхиляє спіраль 12 та запобігає зв'язуванню білків-коактиваторів з мотивами LXXLL. Цього досягають, займаючи лазофоксифеном простір, зазвичай заповнений бічною групою Leu-540, та модулюючи конформацію залишків спіралі 11 (His-524, Leu-525). Крім того, лазофоксифен також безпосередньо перешкоджає позиціонуванню спіралі 12 за допомогою етилпіролідинової групи препарату.[98] Дослідження in vitro показують, що базедоксифен конкурентно блокує 17β-естрадіол шляхом високого та подібного зв'язування як з ERα, так і з ERβ.[99] Основний зв'язувальний домен базедоксифенів складається з 2-феніл-3-метиліндолу та гексаметиленамінового кільця в ураженій ділянці бічного ланцюга.[100]
Оспеміфен є окислювально дезамінованим метаболітом тореміфену, який має подібне зв'язування з ER, як тореміфен і тамоксифен. Конкурентне зв'язування з ERα та ERβ трьох метаболітів: 4-гідроксиоспеміфену, 4'-гідроксиоспеміфену та 4-гідрокси-, карбонової кислоти бічного ланцюга оспеміфену, є щонайменше таким же високим, як і у вихідної сполуки.[101]
Історія

Відкриття SERM було результатом спроб розробити нові контрацептиви. Кломіфен і тамоксифен запобігали зачаттю у щурів, але мали протилежний ефект у людей. Кломіфен успішно індукував овуляцію у жінок зі зниженим фертильністю, і 1 лютого 1967 року його було схвалено в США для лікування дисфункції овуляції у жінок, які намагалися завагітніти.[102] Токсикологічні проблеми перешкодили тривалому використанню кломіфену та подальшій розробці ліків для інших потенційних застосувань, таких як лікування та профілактика раку молочної залози.[103]
Минуло ще десять років, перш ніж тамоксифен був схвалений у грудні 1977 року не як контрацептив, а як гормональний засіб для лікування та профілактики раку молочної залози.[104] Відкриття в 1987 році того, що SERM тамоксифен і ралоксифен, які тоді вважалися антиестрогенами через антагоністичну дію в тканинах молочної залози, проявляють естрогенну дію в запобіганні втраті кісткової маси у щурів після оваріектомії, мало великий вплив на наше розуміння функції естрогенних рецепторів та ядерних рецепторів загалом.[105] Термін SERM був введений для опису цих сполук, які мають комбінацію агоністичної, часткової агоністичної або антагоністичної активності естрогену залежно від тканини.[106] Було показано, що тореміфен сумісний з тамоксифеном, і в 1996 році його було схвалено для використання в лікуванні раку молочної залози у жінок у постменопаузі.[107]
Ралоксифен спочатку провалився як препарат від раку молочної залози через його низьку ефективність у порівнянні з тамоксифеном у лабораторії[108] але естрогенний вплив ралоксифену на кістки призвів до його повторного відкриття та схвалення у 1997 році[109] Він був схвалений для профілактики та лікування остеопорозу та був першим клінічно доступним SERM для запобігання як остеопорозу, так і раку молочної залози.[110] Оспеміфен був схвалений 26 лютого 2013 року для лікування диспареунії середнього та тяжкого ступеня, яка є симптомом атрофії вульви та піхви, спричиненої менопаузою. Комбінована терапія кон'югованими естрогенами та SERM базедоксифеном була схвалена 3 жовтня 2013 року для лікування вазомоторних симптомів, пов'язаних з менопаузою. Базедоксифен також використовується для профілактики постменопаузального остеопорозу.[109] Пошук потужного SERM з ефективністю для кісток та кращою біодоступністю, ніж ралоксифен, призвів до відкриття лазофоксифену.[111] Хоча лазофоксифен був схвалений у 2009 році, він не продавався протягом трьох років після схвалення, тому термін дії дозволу на його продаж закінчився.[112] У Європі базедоксифен показаний для лікування остеопорозу у жінок у постменопаузі з підвищеним ризиком переломів. В Індії ормелоксифен використовувався для лікування дисфункціональних маткових кровотеч та для контрацепції.[109]
Див. також
- Естроген-деприваційна терапія
- Селективний модулятор андрогенних рецепторів
- Селективний деградатор рецепторів естрогену
- Селективний модулятор рецепторів
- Хронологія розвитку методів лікування раку
Примітки
- ↑ Hirsch HD, Shih E, Thacker HL (June 2017). ERAAs for menopause treatment: Welcome the 'designer estrogens'. Cleve Clin J Med. 84 (6): 463—470. doi:10.3949/ccjm.84a.15140. PMID 28628428.
- ↑ Archer DF (August 2020). Ospemifene: less venous thrombosis than other selective estrogen receptor modulators in postmenopausal women with vulvo vaginal atrophy. Menopause. 27 (8): 846—847. doi:10.1097/GME.0000000000001600. PMID 32576803.
- ↑ Riggs BL, Hartmann LC (Feb 2003). Selective estrogen-receptor modulators -- mechanisms of action and application to clinical practice. The New England Journal of Medicine. 348 (7): 618—29. doi:10.1056/NEJMra022219. PMID 12584371.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Pickar JH, Komm BS (Sep 2015). Selective estrogen receptor modulators and the combination therapy conjugated estrogens/bazedoxifene: A review of effects on the breast. Post Reproductive Health. 21 (3): 112—21. doi:10.1177/2053369115599090. PMID 26289836.
- ↑ Xu, Jane Y.; O’Connell, Michele A.; Notini, Lauren; Cheung, Ada S.; Zwickl, Sav; Pang, Ken C. (18 червня 2021). Selective Estrogen Receptor Modulators: A Potential Option For Non-Binary Gender-Affirming Hormonal Care?. Frontiers in Endocrinology (англ.). 12. doi:10.3389/fendo.2021.701364. ISSN 1664-2392. PMC 8253879. PMID 34226826.
- ↑ Hodax, Juanita K.; DiVall, Sara (1 січня 2023). Gender-affirming endocrine care for youth with a nonbinary gender identity. Therapeutic Advances in Endocrinology and Metabolism (англ.). 14: 20420188231160405. doi:10.1177/20420188231160405. ISSN 2042-0188. PMC 10064168. PMID 37006780.
- ↑ Pickar JH, Komm BS (Sep 2015). Selective estrogen receptor modulators and the combination therapy conjugated estrogens/bazedoxifene: A review of effects on the breast. Post Reproductive Health. 21 (3): 112—21. doi:10.1177/2053369115599090. PMID 26289836.
- ↑ а б Mirkin S, Pickar JH (Jan 2015). Selective estrogen receptor modulators (SERMs): a review of clinical data. Maturitas. 80 (1): 52—7. doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Mirkin S, Pickar JH (Jan 2015). Selective estrogen receptor modulators (SERMs): a review of clinical data. Maturitas. 80 (1): 52—7. doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ↑ Pickar JH, Komm BS (Sep 2015). Selective estrogen receptor modulators and the combination therapy conjugated estrogens/bazedoxifene: A review of effects on the breast. Post Reproductive Health. 21 (3): 112—21. doi:10.1177/2053369115599090. PMID 26289836.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Mirkin S, Pickar JH (Jan 2015). Selective estrogen receptor modulators (SERMs): a review of clinical data. Maturitas. 80 (1): 52—7. doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ↑ Pickar JH, Komm BS (Sep 2015). Selective estrogen receptor modulators and the combination therapy conjugated estrogens/bazedoxifene: A review of effects on the breast. Post Reproductive Health. 21 (3): 112—21. doi:10.1177/2053369115599090. PMID 26289836.
- ↑ Pickar JH, Komm BS (Sep 2015). Selective estrogen receptor modulators and the combination therapy conjugated estrogens/bazedoxifene: A review of effects on the breast. Post Reproductive Health. 21 (3): 112—21. doi:10.1177/2053369115599090. PMID 26289836.
- ↑ Mirkin S, Pickar JH (Jan 2015). Selective estrogen receptor modulators (SERMs): a review of clinical data. Maturitas. 80 (1): 52—7. doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ↑ Xu, Jane Y.; O'Connell, Michele A.; Notini, Lauren; Cheung, Ada S.; Zwickl, Sav; Pang, Ken C. (18 червня 2021). Selective Estrogen Receptor Modulators: A Potential Option For Non-Binary Gender-Affirming Hormonal Care?. Frontiers in Endocrinology. 12: 701364. doi:10.3389/fendo.2021.701364. ISSN 1664-2392. PMC 8253879. PMID 34226826.
- ↑ Cameron JL, Cameron AM (20 листопада 2013). Current Surgical Therapy. Elsevier Health Sciences. с. 582–. ISBN 978-0-323-22511-3.
- ↑ а б Huang X, Aslanian RG (19 квітня 2012). Case Studies in Modern Drug Discovery and Development. John Wiley & Sons. с. 392—394. ISBN 978-1-118-21967-6.
- ↑ а б Kremoser C, Albers M, Burris TP, Deuschle U, Koegl M (Oct 2007). Panning for SNuRMs: using cofactor profiling for the rational discovery of selective nuclear receptor modulators. Drug Discovery Today. 12 (19–20): 860—9. doi:10.1016/j.drudis.2007.07.025. PMID 17933688.
- ↑ Rosano C, Stec-Martyna E, Lappano R, Maggiolini M (2011). Structure-based approach for the discovery of novel selective estrogen receptor modulators. Current Medicinal Chemistry. 18 (8): 1188—94. doi:10.2174/092986711795029645. PMID 21291367.
- ↑ а б Nilsson S, Koehler KF, Gustafsson JÅ (Oct 2011). Development of subtype-selective oestrogen receptor-based therapeutics. Nature Reviews. Drug Discovery. 10 (10): 778—92. doi:10.1038/nrd3551. PMID 21921919.
- ↑ Koehler KF, Helguero LA, Haldosén LA, Warner M, Gustafsson JA (May 2005). Reflections on the discovery and significance of estrogen receptor beta. Endocrine Reviews. 26 (3): 465—78. doi:10.1210/er.2004-0027. PMID 15857973.
- ↑ Dutertre M, Smith CL (Nov 2000). Molecular mechanisms of selective estrogen receptor modulator (SERM) action. The Journal of Pharmacology and Experimental Therapeutics. 295 (2): 431—7. doi:10.1016/S0022-3565(24)38923-2. PMID 11046073.
- ↑ а б Rosano C, Stec-Martyna E, Lappano R, Maggiolini M (2011). Structure-based approach for the discovery of novel selective estrogen receptor modulators. Current Medicinal Chemistry. 18 (8): 1188—94. doi:10.2174/092986711795029645. PMID 21291367.
- ↑ Kremoser C, Albers M, Burris TP, Deuschle U, Koegl M (Oct 2007). Panning for SNuRMs: using cofactor profiling for the rational discovery of selective nuclear receptor modulators. Drug Discovery Today. 12 (19–20): 860—9. doi:10.1016/j.drudis.2007.07.025. PMID 17933688.
- ↑ Xu X, Yang W, Li Y, Wang Y (Jan 2010). Discovery of estrogen receptor modulators: a review of virtual screening and SAR efforts. Expert Opinion on Drug Discovery. 5 (1): 21—31. doi:10.1517/17460440903490395. PMID 22823969.
- ↑ Kremoser C, Albers M, Burris TP, Deuschle U, Koegl M (Oct 2007). Panning for SNuRMs: using cofactor profiling for the rational discovery of selective nuclear receptor modulators. Drug Discovery Today. 12 (19–20): 860—9. doi:10.1016/j.drudis.2007.07.025. PMID 17933688.
- ↑ Brzozowski AM, Pike AC, Dauter Z, Hubbard RE, Bonn T, Engström O, Öhman L, Greene GL, Gustafsson JÅ, Carlquist M (1997). Molecular basis of agonism and antagonism in the oestrogen receptor. Nature. 389 (6652): 753—8. Bibcode:1997Natur.389..753B. doi:10.1038/39645. PMID 9338790.
- ↑ Shiau AK, Barstad D, Loria PM, Cheng L, Kushner PJ, Agard DA, Greene GL (1998). The structural basis of estrogen receptor/coactivator recognition and the antagonism of this interaction by tamoxifen. Cell. 95 (7): 927—37. doi:10.1016/S0092-8674(00)81717-1. PMID 9875847.
- ↑ а б в Musa MA, Khan MO, Cooperwood JS (2007). Medicinal chemistry and emerging strategies applied to the development of selective estrogen receptor modulators (SERMs). Current Medicinal Chemistry. 14 (11): 1249—61. doi:10.2174/092986707780598023. PMID 17504144.
- ↑ Riggs BL, Hartmann LC (Feb 2003). Selective estrogen-receptor modulators -- mechanisms of action and application to clinical practice. The New England Journal of Medicine. 348 (7): 618—29. doi:10.1056/NEJMra022219. PMID 12584371.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Lewis JS, Jordan VC (Dec 2005). Selective estrogen receptor modulators (SERMs): mechanisms of anticarcinogenesis and drug resistance. Mutation Research. 591 (1–2): 247—63. Bibcode:2005MRFMM.591..247L. doi:10.1016/j.mrfmmm.2005.02.028. PMID 16083919.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Lewis JS, Jordan VC (Dec 2005). Selective estrogen receptor modulators (SERMs): mechanisms of anticarcinogenesis and drug resistance. Mutation Research. 591 (1–2): 247—63. Bibcode:2005MRFMM.591..247L. doi:10.1016/j.mrfmmm.2005.02.028. PMID 16083919.
- ↑ а б Feng Q, O'Malley BW (Nov 2014). Nuclear receptor modulation--role of coregulators in selective estrogen receptor modulator (SERM) actions. Steroids. 90: 39—43. doi:10.1016/j.steroids.2014.06.008. PMC 4192004. PMID 24945111.
- ↑ Riggs BL, Hartmann LC (Feb 2003). Selective estrogen-receptor modulators -- mechanisms of action and application to clinical practice. The New England Journal of Medicine. 348 (7): 618—29. doi:10.1056/NEJMra022219. PMID 12584371.
- ↑ Musa MA, Khan MO, Cooperwood JS (2007). Medicinal chemistry and emerging strategies applied to the development of selective estrogen receptor modulators (SERMs). Current Medicinal Chemistry. 14 (11): 1249—61. doi:10.2174/092986707780598023. PMID 17504144.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Lewis JS, Jordan VC (Dec 2005). Selective estrogen receptor modulators (SERMs): mechanisms of anticarcinogenesis and drug resistance. Mutation Research. 591 (1–2): 247—63. Bibcode:2005MRFMM.591..247L. doi:10.1016/j.mrfmmm.2005.02.028. PMID 16083919.
- ↑ а б Musa MA, Khan MO, Cooperwood JS (2007). Medicinal chemistry and emerging strategies applied to the development of selective estrogen receptor modulators (SERMs). Current Medicinal Chemistry. 14 (11): 1249—61. doi:10.2174/092986707780598023. PMID 17504144.
- ↑ а б в г Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Lewis JS, Jordan VC (Dec 2005). Selective estrogen receptor modulators (SERMs): mechanisms of anticarcinogenesis and drug resistance. Mutation Research. 591 (1–2): 247—63. Bibcode:2005MRFMM.591..247L. doi:10.1016/j.mrfmmm.2005.02.028. PMID 16083919.
- ↑ а б Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Riggs BL, Hartmann LC (Feb 2003). Selective estrogen-receptor modulators -- mechanisms of action and application to clinical practice. The New England Journal of Medicine. 348 (7): 618—29. doi:10.1056/NEJMra022219. PMID 12584371.
- ↑ Musa MA, Khan MO, Cooperwood JS (2007). Medicinal chemistry and emerging strategies applied to the development of selective estrogen receptor modulators (SERMs). Current Medicinal Chemistry. 14 (11): 1249—61. doi:10.2174/092986707780598023. PMID 17504144.
- ↑ Lewis JS, Jordan VC (Dec 2005). Selective estrogen receptor modulators (SERMs): mechanisms of anticarcinogenesis and drug resistance. Mutation Research. 591 (1–2): 247—63. Bibcode:2005MRFMM.591..247L. doi:10.1016/j.mrfmmm.2005.02.028. PMID 16083919.
- ↑ Riggs BL, Hartmann LC (Feb 2003). Selective estrogen-receptor modulators -- mechanisms of action and application to clinical practice. The New England Journal of Medicine. 348 (7): 618—29. doi:10.1056/NEJMra022219. PMID 12584371.
- ↑ а б Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Lewis JS, Jordan VC (Dec 2005). Selective estrogen receptor modulators (SERMs): mechanisms of anticarcinogenesis and drug resistance. Mutation Research. 591 (1–2): 247—63. Bibcode:2005MRFMM.591..247L. doi:10.1016/j.mrfmmm.2005.02.028. PMID 16083919.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Maximov PY, Lee TM, Jordan VC (May 2013). The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice. Current Clinical Pharmacology. 8 (2): 135—55. doi:10.2174/1574884711308020006. PMC 3624793. PMID 23062036.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Fang H, Tong W, Shi LM, Blair R, Perkins R, Branham W, Hass BS, Xie Q, Dial SL, Moland CL, Sheehan DM (Mar 2001). Structure-activity relationships for a large diverse set of natural, synthetic, and environmental estrogens. Chemical Research in Toxicology. 14 (3): 280—94. CiteSeerX 10.1.1.460.20. doi:10.1021/tx000208y. PMID 11258977.
- ↑ а б в Clark JH, Markaverich BM (1981). The agonistic-antagonistic properties of clomiphene: a review. Pharmacology & Therapeutics. 15 (3): 467—519. doi:10.1016/0163-7258(81)90055-3. PMID 7048350.
- ↑ Fang H, Tong W, Shi LM, Blair R, Perkins R, Branham W, Hass BS, Xie Q, Dial SL, Moland CL, Sheehan DM (Mar 2001). Structure-activity relationships for a large diverse set of natural, synthetic, and environmental estrogens. Chemical Research in Toxicology. 14 (3): 280—94. CiteSeerX 10.1.1.460.20. doi:10.1021/tx000208y. PMID 11258977.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Jensen EV, Jordan VC (Jun 2003). The estrogen receptor: a model for molecular medicine. Clinical Cancer Research. 9 (6): 1980—9. PMID 12796359.
- ↑ Singh MN, Stringfellow HF, Paraskevaidis E, Martin-Hirsch PL, Martin FL (Apr 2007). Tamoxifen: important considerations of a multi-functional compound with organ-specific properties. Cancer Treatment Reviews. 33 (2): 91—100. doi:10.1016/j.ctrv.2006.09.008. PMID 17178195.]
- ↑ Jensen EV, Jordan VC (Jun 2003). The estrogen receptor: a model for molecular medicine. Clinical Cancer Research. 9 (6): 1980—9. PMID 12796359.
- ↑ Morello KC, Wurz GT, DeGregorio MW (30 вересня 2012). Pharmacokinetics of selective estrogen receptor modulators. Clinical Pharmacokinetics. 42 (4): 361—72. doi:10.2165/00003088-200342040-00004. PMID 12648026.
- ↑ de Médina P, Favre G, Poirot M (Nov 2004). Multiple targeting by the antitumor drug tamoxifen: a structure-activity study. Current Medicinal Chemistry. Anti-Cancer Agents. 4 (6): 491—508. doi:10.2174/1568011043352696. PMID 15579015.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Fang H, Tong W, Shi LM, Blair R, Perkins R, Branham W, Hass BS, Xie Q, Dial SL, Moland CL, Sheehan DM (Mar 2001). Structure-activity relationships for a large diverse set of natural, synthetic, and environmental estrogens. Chemical Research in Toxicology. 14 (3): 280—94. CiteSeerX 10.1.1.460.20. doi:10.1021/tx000208y. PMID 11258977.
- ↑ de Médina P, Favre G, Poirot M (Nov 2004). Multiple targeting by the antitumor drug tamoxifen: a structure-activity study. Current Medicinal Chemistry. Anti-Cancer Agents. 4 (6): 491—508. doi:10.2174/1568011043352696. PMID 15579015.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Jensen EV, Jordan VC (Jun 2003). The estrogen receptor: a model for molecular medicine. Clinical Cancer Research. 9 (6): 1980—9. PMID 12796359.
- ↑ а б Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Fang H, Tong W, Shi LM, Blair R, Perkins R, Branham W, Hass BS, Xie Q, Dial SL, Moland CL, Sheehan DM (Mar 2001). Structure-activity relationships for a large diverse set of natural, synthetic, and environmental estrogens. Chemical Research in Toxicology. 14 (3): 280—94. CiteSeerX 10.1.1.460.20. doi:10.1021/tx000208y. PMID 11258977.
- ↑ Morello KC, Wurz GT, DeGregorio MW (30 вересня 2012). Pharmacokinetics of selective estrogen receptor modulators. Clinical Pharmacokinetics. 42 (4): 361—72. doi:10.2165/00003088-200342040-00004. PMID 12648026.
- ↑ Gauthier S, Mailhot J, Labrie F (May 1996). New Highly Stereoselective Synthesis of (Z)-4-Hydroxytamoxifen and (Z)-4-Hydroxytoremifene via McMurry Reaction. The Journal of Organic Chemistry. 61 (11): 3890—3893. doi:10.1021/jo952279l. PMID 11667248.
- ↑ Musa MA, Khan MO, Cooperwood JS (2007). Medicinal chemistry and emerging strategies applied to the development of selective estrogen receptor modulators (SERMs). Current Medicinal Chemistry. 14 (11): 1249—61. doi:10.2174/092986707780598023. PMID 17504144.
- ↑ Morello KC, Wurz GT, DeGregorio MW (30 вересня 2012). Pharmacokinetics of selective estrogen receptor modulators. Clinical Pharmacokinetics. 42 (4): 361—72. doi:10.2165/00003088-200342040-00004. PMID 12648026.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Jensen EV, Jordan VC (Jun 2003). The estrogen receptor: a model for molecular medicine. Clinical Cancer Research. 9 (6): 1980—9. PMID 12796359.
- ↑ Jordan VC (Mar 2003). Antiestrogens and selective estrogen receptor modulators as multifunctional medicines. 2. Clinical considerations and new agents. Journal of Medicinal Chemistry. 46 (7): 1081—111. doi:10.1021/jm020450x. PMID 12646017.
- ↑ Jensen EV, Jordan VC (Jun 2003). The estrogen receptor: a model for molecular medicine. Clinical Cancer Research. 9 (6): 1980—9. PMID 12796359.
- ↑ Jordan VC (Mar 2003). Antiestrogens and selective estrogen receptor modulators as multifunctional medicines. 2. Clinical considerations and new agents. Journal of Medicinal Chemistry. 46 (7): 1081—111. doi:10.1021/jm020450x. PMID 12646017.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Vajdos FF, Hoth LR, Geoghegan KF, Simons SP, LeMotte PK, Danley DE, Ammirati MJ, Pandit J (May 2007). The 2.0 A crystal structure of the ERalpha ligand-binding domain complexed with lasofoxifene. Protein Science. 16 (5): 897—905. doi:10.1110/ps.062729207. PMC 2206632. PMID 17456742.
- ↑ Rosano C, Stec-Martyna E, Lappano R, Maggiolini M (2011). Structure-based approach for the discovery of novel selective estrogen receptor modulators. Current Medicinal Chemistry. 18 (8): 1188—94. doi:10.2174/092986711795029645. PMID 21291367.
- ↑ Kung AW, Chu EY, Xu L (Jun 2009). Bazedoxifene: a new selective estrogen receptor modulator for the treatment of postmenopausal osteoporosis. Expert Opinion on Pharmacotherapy. 10 (8): 1377—85. doi:10.1517/14656560902980228. PMID 19445558.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Gennari L, Merlotti D, Valleggi F, Nuti R (Jun 2009). Ospemifene use in postmenopausal women. Expert Opinion on Investigational Drugs. 18 (6): 839—49. doi:10.1517/13543780902953715. PMID 19466874.
- ↑ Nilsson S, Koehler KF, Gustafsson JÅ (Oct 2011). Development of subtype-selective oestrogen receptor-based therapeutics. Nature Reviews. Drug Discovery. 10 (10): 778—92. doi:10.1038/nrd3551. PMID 21921919.
- ↑ Vajdos FF, Hoth LR, Geoghegan KF, Simons SP, LeMotte PK, Danley DE, Ammirati MJ, Pandit J (May 2007). The 2.0 A crystal structure of the ERalpha ligand-binding domain complexed with lasofoxifene. Protein Science. 16 (5): 897—905. doi:10.1110/ps.062729207. PMC 2206632. PMID 17456742.
- ↑ Nilsson S, Koehler KF, Gustafsson JÅ (Oct 2011). Development of subtype-selective oestrogen receptor-based therapeutics. Nature Reviews. Drug Discovery. 10 (10): 778—92. doi:10.1038/nrd3551. PMID 21921919.
- ↑ а б Rosano C, Stec-Martyna E, Lappano R, Maggiolini M (2011). Structure-based approach for the discovery of novel selective estrogen receptor modulators. Current Medicinal Chemistry. 18 (8): 1188—94. doi:10.2174/092986711795029645. PMID 21291367.
- ↑ а б Taneja SS, Smith MR, Dalton JT, Raghow S, Barnette G, Steiner M, Veverka KA (Mar 2006). Toremifene--a promising therapy for the prevention of prostate cancer and complications of androgen deprivation therapy. Expert Opinion on Investigational Drugs. 15 (3): 293—305. doi:10.1517/13543784.15.3.293. PMID 16503765.
- ↑ Fang H, Tong W, Shi LM, Blair R, Perkins R, Branham W, Hass BS, Xie Q, Dial SL, Moland CL, Sheehan DM (Mar 2001). Structure-activity relationships for a large diverse set of natural, synthetic, and environmental estrogens. Chemical Research in Toxicology. 14 (3): 280—94. CiteSeerX 10.1.1.460.20. doi:10.1021/tx000208y. PMID 11258977.
- ↑ Rosano C, Stec-Martyna E, Lappano R, Maggiolini M (2011). Structure-based approach for the discovery of novel selective estrogen receptor modulators. Current Medicinal Chemistry. 18 (8): 1188—94. doi:10.2174/092986711795029645. PMID 21291367.
- ↑ Rosano C, Stec-Martyna E, Lappano R, Maggiolini M (2011). Structure-based approach for the discovery of novel selective estrogen receptor modulators. Current Medicinal Chemistry. 18 (8): 1188—94. doi:10.2174/092986711795029645. PMID 21291367.
- ↑ Palacios S (2006). Endometrial Effects of SERMs. У Sanchez (ред.). Selective estrogen receptor modulators a new brand of multitarget drugs (вид. 1st). Berlin: Springer. с. 282—3. doi:10.1007/3-540-34742-9_11. ISBN 978-3-540-24227-7.
- ↑ Kung AW, Chu EY, Xu L (Jun 2009). Bazedoxifene: a new selective estrogen receptor modulator for the treatment of postmenopausal osteoporosis. Expert Opinion on Pharmacotherapy. 10 (8): 1377—85. doi:10.1517/14656560902980228. PMID 19445558.
- ↑ Senshio (ospemifene). The European Medicines Agency (EMA). Архів оригіналу за 20 червня 2018. Процитовано 2 листопада 2015.
- ↑ Pickar JH, Komm BS (Sep 2015). Selective estrogen receptor modulators and the combination therapy conjugated estrogens/bazedoxifene: A review of effects on the breast. Post Reproductive Health. 21 (3): 112—21. doi:10.1177/2053369115599090. PMID 26289836.
- ↑ Mirkin S, Pickar JH (Jan 2015). Selective estrogen receptor modulators (SERMs): a review of clinical data. Maturitas. 80 (1): 52—7. doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ↑ Mirkin S, Pickar JH (Jan 2015). Selective estrogen receptor modulators (SERMs): a review of clinical data. Maturitas. 80 (1): 52—7. doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Pickar JH, Komm BS (Sep 2015). Selective estrogen receptor modulators and the combination therapy conjugated estrogens/bazedoxifene: A review of effects on the breast. Post Reproductive Health. 21 (3): 112—21. doi:10.1177/2053369115599090. PMID 26289836.
- ↑ Fareston. European Medicines Agency (EMA). Архів оригіналу за 20 червня 2018. Процитовано 2 листопада 2015.
- ↑ Musa MA, Khan MO, Cooperwood JS (2007). Medicinal chemistry and emerging strategies applied to the development of selective estrogen receptor modulators (SERMs). Current Medicinal Chemistry. 14 (11): 1249—61. doi:10.2174/092986707780598023. PMID 17504144.
- ↑ а б в Mirkin S, Pickar JH (Jan 2015). Selective estrogen receptor modulators (SERMs): a review of clinical data. Maturitas. 80 (1): 52—7. doi:10.1016/j.maturitas.2014.10.010. PMID 25466304.
- ↑ Miller CP (2002). SERMs: evolutionary chemistry, revolutionary biology. Current Pharmaceutical Design. 8 (23): 2089—111. doi:10.2174/1381612023393404. PMID 12171520.
- ↑ Rosano C, Stec-Martyna E, Lappano R, Maggiolini M (2011). Structure-based approach for the discovery of novel selective estrogen receptor modulators. Current Medicinal Chemistry. 18 (8): 1188—94. doi:10.2174/092986711795029645. PMID 21291367.
- ↑ Fablyn. The European Medicines Agency (EMA). Архів оригіналу за 12 лютого 2018. Процитовано 2 листопада 2015.








