
Перокси́ди (англ. peróxides) — хімічні сполуки, що містять пероксидну групу . В органічних пероксидах група з'єднана ковалентним зв'язком з хоча б одним атомом вуглецю. Неорганічні пероксиди здебільшого тверді солеподібні з іонним типом зв'язку. Дуже активні сполуки, легко розкладаються, є сильними окисниками. Багато органічних пероксидів є вибухонебезпечними.
Історія відкриття
Один із перших синтетичних пероксидів, пероксид барію, був синтезований в 1799 році Александром фон Гумбольтом в результаті спроби розділення повітря. Через 19 років Луї Жак Тенар дослідив цю сполуку та визначив, що вона може бути використана для синтезу іншої, ще невідомої сполуки, яку він назвав "окиснена вода" — наразі відома як перекис водню.[1]
Неорганічні пероксиди

Група неорганічних пероксидів поділяється на іонні солі пероксид-іонів та неорганічні пероксиди, що мають ковалентно пов'язані пероксидні групи. До першого класу відносяться пероксиди лужних і лужноземельних металів. Найвизначнішим представником другого класу є ковалентний перекис водню; однак, важливе значення мають також деякі пероксиди мінеральних кислот, таких як кислота Каро та пероксокарбонатна кислота. На відміну від іонного характеру пероксидів лужних металів, пероксиди перехідних металів мають більш ковалентний характер, що пояснюється їх більшою електронегативністю.[2]
Отримання
Іонні пероксиди
Пероксиди лужних металів, за винятком пероксиду літію, можна отримати безпосередньо шляхом окиснення цих металів киснем при нормальному тиску:[2]
Пероксид літію можна отримати шляхом взаємодії гідроксиду літію з перекисом водню:[2]
Пероксид барію, який історично використовувався для отримання перекису водню, може бути отриманий шляхом окиснення оксиду барію при підвищеній температурі та тиску:[3]
Ковалентні пероксиди

Найпоширенішим методом синтезу перекису водню є антрахіноновий процес. Антрахінон спочатку відновлюєтьсядо антрагідрохінону за допомогою водню у присутності паладієвого каталізатору. Далі, окиснення киснем призводить до утворення перекису водню та антрахінону.[3] Таким чином, загальне рівняння реакції має вигляд:
Прямий синтез перекису водню з елементів на сьогодні неможливий в промислових масштабах.[3]
Мінеральні надкислоти (наприклад, пероксодісульфати[4] та пероксокарбонати[5]) можуть бути синтезовані шляхом анодного окислення відповідних кислот:
Пероксодісульфатна кислота історично використовувалась для отримання перекису водню на початку XX століття:[3][6]
Використання
Пероксиди є сильними окисниками і їх можна використовувати для окиснення інших сполук. Пероксиди лужних металів можуть бути використані для синтезу органічних пероксидів, наприклад бензоїлпероксиду.[7]

Неорганічні пероксиди використовуються як відбілюючі речовини в текстильній та паперовій промисловості,[3] чим значною мірою замінили старіший підхід, заснований на відбілювальній дії хлоровмісних сполук.[6] В домашньому господарстві пероксиди загалом зустрічаються в засобах для прання.[8] У минулому для цього використовували перборати, але їх значною мірою витіснили перкарбонати через збільшення концентрації бору в навколишньому середовищі. Пероксовмісні засоби можуть мати відповідні торгові найменування; наприклад, "Persil" походить від слів Perborate і Silicate.
Реакція з вуглекислим газом може вивільняти кисень з деяких пероксидних солей з утворенням карбонатів. Це використовується в генераторах кисню в дихальних апаратах, підводних човнах або космічних апаратах.
Для цього в більшості випадків використовують пероксид натрію, але, наприклад, в космічних апаратах віддається перевага пероксиду літію, оскільки він має меншу молярну масу і тому здатний виробляти більший об'єм кисню на одиницю ваги.[3]
Пероксид барію історично використовувався для отримання чистого кисню з повітря. Для цього використовували залежну від температури рівновагу між оксидом та пероксидом барію. Спочатку пероксид утворювався при нагріванні оксиду барію на повітрі до 500 °С. При температурі вище 700 °C та відсутності кисню пероксид знов розпадався на оксид та кисень:[3]
Органічні пероксиди
Органічні пероксиди — це органічні сполуки, похідні пероксиду водню, де щонайменш один атом водню заміщений органічним фрагментом.
Властивості
В залежності від структури органічних замісників, органічні пероксиди можна поділити на декілька класів:[8]
![103x103пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/75/Hydroperoxide.svg/220px-Hydroperoxide.svg.png)
Органічні гідропероксиди |
![149x149пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Peroxide.svg/220px-Peroxide.svg.png)
Діалкільні пероксиди |
![140x140пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/bc/Acyl_peroxide.svg/220px-Acyl_peroxide.svg.png)
Діацильні пероксиди |
![101x101пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/60/Peracid.svg/220px-Peracid.svg.png)
(надкарбонові кислоти) |
![115x115пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/16/Peresters.svg/220px-Peresters.svg.png)
Пероксиестери (перестери) |
![142x142пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/94/Peroxycarbonates_1.svg/220px-Peroxycarbonates_1.svg.png)
Пероксикарбонати |
![161x161пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/Peroxyketals.svg/220px-Peroxyketals.svg.png)
Пероксикеталі |
![141x141пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/77/Ketone_peroxides.svg/220px-Ketone_peroxides.svg.png)
Пероксиди кетонів |
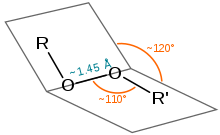
Довжина зв'язку в пероксидах становить близько 1,45 Å, кути (R = H, C) становлять приблизно 110° (подібні до води), а двогранні кути (R = H, C) — приблизно 120°. Енергія дисоціації зв'язку доволі низька – 45-50 ккал·моль−1 (1900–210 кДж·моль−1).[9][10]
Відомо, що органічні пероксиди є сильними окисниками, але квантифікувати їхні окисно-відновні властивості дуже важко: циклічна вольтаметрія, що зазвичай застосовується для визначення редокс-потенціалу, у випадку пероксидів результує незворотні цикловольтамограми, аналіз яких потребує детального вивчення механізму відновлення конкретного пероксиду, а також дослідження впливу варіації умов (у першу чергу, pH).[11] Наразі точно встановленим є редокс-потенціал надоцтової кислоти — 1,762 В проти Ag/AgCl (NaCl нас.),[11] або 1,960 В проти водневого електроду.[12] Для порівняння, редокс-потенціал пероксиду водню — 1,776 В проти водневого електроду;[13] тобто, надоцтова кислота має бути сильнішим окисником, аніж пероксид водню.
Пероксикарбонові кислоти є, як правило, слабкішими кислотами, аніж відповідні карбонові кислоти.[14]
Отримання
Діалкілпероксиди можуть бути отримані в результаті реакції між діалкілсульфатом та лужним перекисом водню:[15]
Цей спосіб також може давати циклічні пероксиди.[16] Чотиричленні діоксетани можуть бути отримані шляхом [2+2]-циклоприєднання кисню до алкенів.[14]
Цільовий синтез гідропероксидів може здійснюватися радикальним окисленням алканів киснем. Первинний радикал, утворений радикальним ініціатором, реагує з киснем, утворюючи гідропероксильний радикал. Останній здатен відщеплювати атоми водню від іншої молекули алкану, що продовжує радикальний ланцюг:[14]

Така реакція використовується в промислових масштабах, наприклад, в куменовому методі.[17] Подібна радикальна реакція, спонукована атмосферним киснем, також може повільно відбуватись у речовинах, що можуть утворювати стійкі радикали. Наприклад, це призводить до самоокислення розчинників з групи простих ефірів, таких як діетиловий ефір, діізопропілового, тетрагідрофуран або 1,4-діоксан. Продуктами є гідропероксиди простих ефірів, які можуть стати причиною сильних вибухів при нагріванні або концентруванні.[14]

Пероксиди можуть утворюватися в організмах в результаті енової реакції (конкретніше, енової реакції Шенка (англ. Schenk ene reaction) або реакції Дільса-Альдера ненасичених зв'язків із киснем. Субстратами для енової реакції можуть бути ненасичені жирні кислоти, а для циклізації Дільса-Альдера — ненасичені амінокислоти, такі як гістидин.[18] Пероксиди утворюються поряд із спиртами, альдегідами й карбоновими кислотами у процесі згіркнення жирів. Це дозволяє виявити прогірклий жир чи олію за допомогую оцінки пероксидного числа, яке вказує на кількість пероксидів на кілограм речовини.[19]
Більшість надкарбонових кислот можна отримати за допомогою реакції перекису водню з відповідною карбоновою кислотою або її хлоридом:
Ароматичні альдегіди можуть вступати в реакцію автоокиснення, утворюючи надкислоти; однак, останні одразу ж реагують із сусідніми молекулами альдегіду й відновлюються до карбонових кислот:
Використання
Зв'язок є доволі нестабільним, тому легко розривається, утворюючи вільні радикали . Розщеплення може бути викликане підвищенням температури (термоліз), світловими хвилями (фотоліз) або хімічними реакціями. Таким чином, органічні пероксиди є корисними як ініціатори деяких видів полімеризації. Наприклад, перекис дібензоїлу використовується для полімеризації акрилатів;[20] пероксид метилетилкетону, пероксид бензоїлу та меншою мірою пероксид ацетону використовуються як ініціатори радикальної полімеризації деяких смол, наприклад, поліестеру та силікону; гідропероксид пінану використовується у виробництві синтетичного каучуку.
Органічні пероксиди, як і їх неорганічні аналоги, також є потужними відбілюючими засобами.[8] Перекис бензоїлу та перекис водню використовуються як відбілюючі та «дозріваючі» засоби при обробці борошна. Перекис бензоїлу є ефективним місцевим препаратом для лікування більшості форм прищів.
Надкислоти широко використовуються для синтезу епоксидів (реакції Прилежаєва)[21] та лактонів з циклічних кетонів (реакція Байєра-Вілліґера).[22] Для цих реакцій часто використовують мета-хлорнадбензойну кислоту (mCPBA).
Трет-бутилгідропероксид використовується в якості окисника в реакції енантіоселективного синтезу епоксидів за Шарплессом[en].[23][24]
Через вибухонебезпечність, деякі пероксиди використовуються як первинні вибухові речовини. Найвідоміші з них: пероксид ацетону (APEX) та гексаметилентрипероксиддіамін (HMTD).

Роль пероксидів в біології
Пероксиди відіграють важливу роль у біології. Багато пероксидів та гідропероксидів є похідними жирних кислот, стероїдів та терпенів. Біосинтез простагландинів протікає за допомогою ендопероксидів.[25]
В пероксисомах еукаріотичних клітин відбувається β-окислення жирних кислот пероксидними інтермедіатами:[26]
- FAD = Флавінаденіндинуклеотид
Пероксиди також грають роль у процесі біолюмінесценції. У світлячкових окислення люциферинів, яке каталізується люциферазами, дає пероксисполуку 1,2-діоксетан. Діоксетан нестійкий і спонтанно розпадається до вуглекислого газу та збудженого кетону, який повертається до основного електронного стану, випромінюючи світло.[27]

Довідки
- ↑ L. W. Gilbert (1820). Der tropfbar flüssige Sauerstoff, oder das oxygenierte Wasser. Annals of Physics (German) . 65—66: 3. Архів оригіналу за 26 січня 2020. Процитовано 18 грудня 2012.
- ↑ а б в Vol'nov, Il'ya Ivanovich. (1966). Peroxides, Superoxides, and Ozonides of Alkali and Alkaline Earth Metals. Boston, MA: Springer US. ISBN 978-1-4684-8252-2. OCLC 840289714.
- ↑ а б в г д е ж Holleman, A. F., Wiberg N., Wiberg E., Fischer G. (2007). Lehrbuch der Anorganischen Chemie. de Gruyter. ISBN 978-3-11-083817-6. OCLC 1102802853.
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. 311–312, Hirzel Verlag, Stuttgart 1995, ISBN 978-3-7776-0672-9.
- ↑ E. H. Riesenfeld, B. Reinhold: Die Existenz echter Percarbonate und ihre Unterscheidung von Carbonaten mit Krystall-Wasserstoffsuperoxyd, in: Berichte Dtsch. Chem. Ges. 1909, 42, 4377–4383; doi:10.1002/cber.19090420428.
- ↑ а б H. Offermanns, G. Dittrich, N. Steiner: Wasserstoffperoxid in Umweltschutz und Synthese, in: Chemie in unserer Zeit 2000, 34, 150–159.
- ↑ S. Gambarjan: Diphenylamin und Acylperoxyde, in: Chem. Ber., 1909, 42, 4003–4013; doi:10.1002/cber.190904203164.
- ↑ а б в Bohnet, Matthias, 1933-. Ullmann's encyclopedia of industrial chemistry (вид. Sixth edition). Weinheim, Germany. ISBN 978-3-527-30673-2. OCLC 751968805. Архів оригіналу за 20 вересня 2020. Процитовано 1 січня 2020.
- ↑ Bach, Robert D.; Ayala, Philippe Y.; Schlegel, H. B. (1996). A Reassessment of the Bond Dissociation Energies of Peroxides. An ab Initio Study. J. Am. Chem. Soc. 118 (50): 12758—12765. doi:10.1021/ja961838i.
- ↑ Otto Exner (1983). Stereochemical and conformational aspects of peroxy compounds. У Saul Patai (ред.). PATAI'S Chemistry of Functional Groups. Wiley. с. 85—96. doi:10.1002/9780470771730.ch2. ISBN 9780470771730.
- ↑ а б Awad, Mohamed Ismail; Denggerile, Ao; Ohsaka, Takeo (2004). Electroreduction of Peroxyacetic Acid at Gold Electrode in Aqueous Media. Journal of The Electrochemical Society (англ.). Т. 151, № 12. с. E358. doi:10.1149/1.1812733.
- ↑ Luukkonen, Tero; Pehkonen, Simo O. (2 січня 2017). Peracids in water treatment: A critical review. Critical Reviews in Environmental Science and Technology. Т. 47, № 1. с. 1—39. doi:10.1080/10643389.2016.1272343. ISSN 1064-3389.
- ↑ W. M. Haynes, CRC Handbook of Chemistry and Physics, 97th Edition, CRC Press, 2016—2017
- ↑ а б в г Becker, Heinz Georg Osmar. (2001). Organikum : organisch-chemisches Grundpraktikum (вид. 21., neu bearb. und erw. Aufl). Weinheim: Wiley-VCH. ISBN 3-527-29985-8. OCLC 52657057.
- ↑ Medwedew, S. S.; Alexejewa, E. N. (1932). Organic peroxides II. Of the reaction between benzoyl hydroperoxide or benzoyl peroxide and triphenylmethyl. Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 65 (2): 137. doi:10.1002/cber.19320650204.
- ↑ Criegee, Rudolf; Müller, Gerhard (1956). 1.2-Dioxan. Chemische Berichte. 89 (2): 238. doi:10.1002/cber.19560890209.
- ↑ R. Brückner: Reaktionsmechanismen. 3. Auflage, S. 41–42, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.
- ↑ A. P. Autor (Hrsg.): Pathology of Oxygen, 1. Auflage, S. 25–26, Academic Press, New York 1982, ISBN 0-12-068620-1.
- ↑ Hagers Handbuch der pharmazeutischen Praxis. Springer DE. с. 328. ISBN 3-540-52688-9.
- ↑ Thomas Brock, Michael Groteklaes, Peter Mischke Lehrbuch der Lacktechnologie, Vincentz Network GmbH & Co KG, 2000, ISBN 3-87870-569-7 p. 67
- ↑ Beyer-Walter: Lehrbuch der Organischen Chemie, 23. Auflage, S. 76–77, S. Hirzel Verlag, Stuttgart · Leipzig 1998. ISBN 3-7776-0808-4.
- ↑ K. P. C. Vollhardt und N. E. Schore: Organische Chemie 3. Auflage, S. 818—819, Wiley-VCH, 2000, ISBN 3-527-29819-3.
- ↑ Katsuki, Tsutomu; Sharpless, K. Barry (1980-08). The first practical method for asymmetric epoxidation. Journal of the American Chemical Society (англ.). Т. 102, № 18. с. 5974—5976. doi:10.1021/ja00538a077. ISSN 0002-7863. Архів оригіналу за 1 січня 2020.
- ↑ J. Gordon Hill, K. Barry Sharpless, Christopher M. Exon, Ronald Regenye (1985). Enantioselective epoxidation of allylic alcohols: (2S,3S)-3-propyloxiranemethanol. Organic Syntheses. Т. 63. с. 66. doi:10.15227/orgsyn.063.0066. Архів оригіналу за 4 липня 2020.
- ↑ D. A. Casteel (1992). Peroxy Natural Products. Natural Product Reports. 9 (4): 289—312. doi:10.1039/np9920900289.
- ↑ Lehninger: Biochemie. 3. Auflage, S. 663–664, Springer, 2001, ISBN 3-540-41813-X.
- ↑ Aldo Roda Chemiluminescence and Bioluminescence: Past, Present and Future [Архівовано 30 грудня 2019 у Wayback Machine.], p. 57, Royal Society of Chemistry, 2010, ISBN 1-84755-812-7














![{\displaystyle {\ce {2HSO4^{-}->[10^{\circ }C][{-e^{-}}]2H^{+}\ +S2O8^{2}-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/531a5390ff05f1cd7eb7d7f85a7f5694d95fadab)



![167x167пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a2/Peroxycarbonates_2.svg/220px-Peroxycarbonates_2.svg.png)








